Información genética que fluye en una célula de ADN y ARN con proteínas.
ADN
La información para fabricar las proteínas necesarias y las enzimas que realizarán las transformaciones químicas de los compuestos, es lo que denominamos la información genética. La célula tiene almacenada en el ADN (ácido desoxirribonucleico), la información genética, que reside en el núcleo celular, donde se encuentran toda la información genética de los individuos.
En su estructura podemos citar que formado un nucleótido que contiene tres componentes: una pentosa (ribosa ó desoxirribosa), un fosfato, y una base nitrogenada (Adenina, Citosina, Guanina, Timina ó Uracilo). Algunos de ellos actúan sin formar ácidos nucleico, es decir, sin unirse entre sí, y su función es imprescindible: ATP, con función energética, coenzimas como el NAD, transportador de e- y H+, etc. Cuando se unen entre sí muchos mono nucleótidos, mediante enlaces fosfodiéster 5' —› 3' (esta notación indica que los nucleótidos se unen entre el C5 de la pentosa de uno de ellos y el C3 de la pentosa del siguiente nucleótido), se forma un polinucleótido ó ácido nucleico. (1)
Las funciones de las bases nitrogenadas son la duplicación del ADN, Transcripción y Traducción.
Como duplicación se entiende proceso mediante el cual el ADN es duplicado, ocurriendo en la fase S del ciclo celular, antes de la meiosis. En este proceso intervienen gran cantidad de enzimas: polimerasa, ligasas, helicasas, entre otras.
Podemos definir las enzimas participantes en la replicación del ADN
1. ADN Topoisomerasa: Elimina la tensión en la doble hélice.
2. ADN Helicasa: Abre la doble cadena de ADN para sintetizar pequeños fragmentos de ARN que sirve como iniciadores de la replicación.
3. ADN polimerasa: se encarga de añadir los nuevos nucleótidos que formaran la nueva cadena de ADN. Solo adiciona de 5=>3.
4. Proteínas estabilizadoras: Sirven para que no se enrolle el ADN.
5. ADN Ligasa: Une los nucleótidos adyacentes que coloca el ADN polimerasa.
6. Enzimas reparadoras del ADN: estas enzimas se encargan de corregir los errores de la ADN polimerasa.
Figura 2 Duplicación de ADN ( fuente 2)
Finalmente el ADN se empaqueta asociándose con proteínas (normalmente histonas), en cinco niveles:
1)Collar de perlas, formando la fibra de cromatina: DNA asociado con histonas.
2) Enrollamiento en solenoide.
3) Bucles de solenoides.
4) Rosetas y rodillos.
2) Enrollamiento en solenoide.
3) Bucles de solenoides.
4) Rosetas y rodillos.
5) Cromosoma (sucesión de rodillos).(2)
Figura 3 Empaquetamiento de ADN (fuente 3)
ARN
El dogma central de la biología molecular es:
ADN ---------> ARN --------> PROTEINAS replicación --> transcripción --> traducción. Es un flujo unidireccional de información aunque en algunos virus se sintetiza ADN a partir de ARN con la retro transcripción o transcripción inversa.(3)
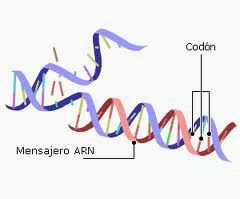
ARN Mensajero: El ARNm es un completo reflejo de las bases del DNA, es muy heterogéneo con respecto al tamaño, ya que las proteínas varían mucho en sus pesos moleculares. Es capaz de asociarse con ribosomas para la síntesis de proteínas y poseen una alta velocidad de recambio debido a que se degradaría rápidamente también contienen U en lugar de T. (3)
Figura 4 ARN mensajero (Fuente 4)
Cuadro comparativo
ADN | ARN | |
Tamaño | - Muy grande | - Pequeño |
Estructura | - Bicatenario (doble cadena)(excepto en ciertos virus) | - Monocatenario (1 cadena)(excepto en ciertos virus) |
Disposición | - Abierta (eucariotas) - Circular (procariotas) | - Abierta (normalmente) |
Tipo de pentosa | - Desoxirribosa | - Ribosa |
Bases nitrogenadas | - A, C, G, T | - A, C, G, U |
Función | -Duplicación (reproducción) - Transcripción (formación de RNA) - Almacenamiento de la información genética | - Traducción (formación de proteínas) |
Por Kimberly Marín Rodríguez
Universidad internacional de las Américas
Facultad de Farmacia
I cuatrimestre, 2011
Referencias
(1)Centro Nacional de Información y Comunicación Educativa.2011.Las Biomoleculas. En línea. Fecha de consulta Marzo 2011.Disponible en http://recursos.cnice.mec.es/biologia/bachillerato/segundo/biologia/ud01/02_01_04_02_026.html
(2) Zamudio Teodora. Fecha de consulta Marzo 2011. En línea. Encuéntrese en http://www.biotech.bioetica.org/clase1-12.htm
(3) Ciencia y biología. Fecha de consulta Abril 2011. En línea. Disponible en: http://www.cienciaybiologia.com/bgeneral/transcripcion-arn.htm
Fuentes
(2)http://www.iesfuentenueva.net/proyecto/index.php?option=com_content&view=article&id=435:35-amplificacion-del-adn-reaccion-en-cadena-de-la-polimerasa&catid=108:la-revolucion-genetica&Itemid=139
(3)http://www.educarchile.cl/Portal.Base/Web/VerContenido.aspx?GUID=48ae7c2a-d317-41d5-a27f-089f378fe70b&ID=136078
Síntesis de proteínas a partir de las instrucciones en el ADN.
Describir la síntesis de proteínas y el ADN dentro de la célula es como describir un círculo ya que ADN dirige la síntesis del ARN, y el ARN dirige la síntesis de proteínas y finalmente una serie de proteínas específicas catalizan la síntesis del ADN y ARN.
Cuatro son las reglas que siguen las células para la síntesis de proteínas y ácidos nucleico:
- Las proteínas y los ácidos nucleicos están compuestos por un número limitado de subunidades: en el caso de las proteínas, son 20 los aminoácidos que constituyen estas subunidades, mientras que sólo cuatro bases nucleicas son utilizadas para construir el ARN o el ADN.
- Durante el proceso de polimerización, las subunidades son añadidas una a una: el caso de las proteínas, la síntesis empieza en el grupo NH2 del aminoácido inicial y continua hasta el -COOH del aminoácido terminal; en el caso de los ácidos nucleícos, la síntesis comienza por el extremo 5' y prosigue hasta el extremo 3´.
- Cada cadena tiene un punto específico de iniciación y el crecimiento procede en una dirección hasta una terminación también especificada. Esto requiere unas señales de inicio y de fin.
- El producto sintético primario no es usualmente empleado como tal sino que es modificado. Mediante una serie de enzimas, las cadenas de polímeros experimentan una serie de transformaciones (rotura, unión a otra cadena, entrecruzamiento, entre otras.(1)
Las instrucciones para construir las proteínas están codificadas en el ADN y las células tienen que traducir esta información a las proteínas este proceso consta de dos etapas: transcripción y traducción.
1. Transcripción:
La transcripción es el proceso durante el cual la información genética contenida en el ADN es copiado a un ARN de una cadena única llamado ARN-mensajero. La transcripción es catalizada por una enzima llamada ARN-polimerasa. El proceso se inicia separándose una porción de las cadenas de ADN: una de ellas, llamada hebra sentido es utilizada como molde por la ARN-polimerasa para incorporar nucleótidos con bases complementarias dispuestas en la misma secuencia que en la hebra anti-sentido, complementaria de la hebra sentido inicial. La única diferencia consiste en que la Timina del ADN inicial es sustituida por uracilo en el ARN mensajero. Así, por ejemplo, una secuencia ATGCAT de la hebra sentido del ADN inicial producirá una secuencia UACGUA. (1)
Además de las secuencia de nucleótidos que codifican proteínas, el ARN mensajero copia del ADN inicial unas regiones que no codifican proteínas y que reciben en nombre de intrones. Las partes que codifican proteínas se llaman exones. Por lo tanto, el ARN inicialmente transcrito contiene tanto exones como intrones. Sin embargo, antes de que abandone el núcleo para dirigirse al citoplasma donde se encuentran los ribosomas, este ARN es procesado mediante operaciones de "corte y empalme", eliminándose los intrones y uniéndose entre sí los exones. Este ARN-m maduro es el que emigra al citoplasma. Un único gen puede codificar varias proteínas si el ARN-m inicial puede ser cortado y empalmado de diversas formas. Esto ocurre, por ejemplo, durante la diferenciación celular en donde las operaciones de corte y pegado permiten producir diferentes proteínas. (2)
Además de utilizarse como molde para la síntesis del ARN-m, el ADN también permite la obtención de otros dos tipos de ARN:
1. El ARN de transferencia (t-ARN) que se une específicamente a cada uno de los 20 aminoácidos y los transporte al ribosoma para incorporarlos a la cadena polipeptídica en crecimiento.
2. El ARN ribosómico (r-ARN) que conjuntamente con las proteínas ribosómicas constituye el ribosoma.
Figura 3 transcripción ARN (3)
1. Traducción
El m-ARN maduro contiene la información para que los aminoácidos que constituyen una proteína según la secuencia correcta. Para ello, cada 3 pares de nucleótidos consecutivos (codón) especifica un aminoácido. Dado que el m-ARN contiene 4 bases, el número de combinaciones posibles de grupos de 3 es de 64, número más que suficiente para codificar los 20 aminoácidos. De hecho, un aminoácido puede ser codificado por varios codones. (3) (1)
A partir del anterior proceso se puede definir como gen un conjunto de nucleótidos de una molécula de ADN que sirve como molde para la producción de una proteína o una familia de proteínas si se producen operaciones de corte y empalme en el ARN. Como usualmente una proteína tiene entre 100 y 1000 aminoácidos, el m-ARN maduro contendrá entre 300 y 3000 nucleótidos. El tamaño del gen dependerá, de los intrones que tenga. (3)
1. Iniciación: Un factor de iniciación, GPT y metionil-tARN [Met] forman un complejo que se une a la subunidad ribosómica grande. A su vez, el m-ARN y la subunidad ribosómica pequeña se unen al encontrar esta última el codón de iniciación que lleva el primero. A continuación ambas subunidades ribosómicas se unen. El metionil-tARN [met] está posicionado enfrente del codón de iniciación (AUG). El GPT y los factores de iniciación de desprenden quedando el tARN [Met] unido al ribosoma. (1)
2. Elongación: Un segundo aminoacil-tARN se coloca en la posición A de la subunidad grande del ribosoma. Un complejo activado por GPT se ocupa de formar el enlace peptídico quedando el peptido en crecimiento unido al aminoacil-tARN entrante. Al mismo tiempo, el primer t-ARN se separa del primer aminoácido y del punto P del ribomosa. El ribosoma se mueva un triplete hacia la derecha, con los que el peptidil-tARN [Phi] queda unido al punto P que había quedado libre. Un tercer aminoacil-tARN (en el ejemplo Leu-tARN [Leu]) se coloca en la posición A y se repite el proceso de formación del enlace peptídico, quedando el peptido en crecimiento unido al Leu-tARN [Leu] entrante. Se separa el segundo t-ARN del segundo aminoácido y del punto P del ribosoma. (1)
3. Terminación: el m-ARN que se está traduciendo lleva un codón de terminación (UAG). Cuando el ribosoma llega a este codón, la proteína ensamblada es liberada y el ribosoma se fragmenta en sus subunidades quedando listo para un nuevo proceso. (1)
La síntesis de proteínas progresa a razón de 15 aminoácidos/segundo. Dada la longitud del m-ARN, varios ribosomas pueden ir leyendo codones y sintetizando proteínas. El conjunto se denomina poliribosoma.
Por Kimberly Marín Rodríguez
Universidad internacional de las Américas
Facultad de Farmacia
I cuatrimestre, 2011
Referencias
(1) Curso de fisiología.2000. Síntesis de proteínas y Ácidos nucleicos. Fecha de consulta 2 Abril 2011.En línea. Disponible en: http://www.iqb.es/cbasicas/fisio/cap04/cap4_2.htm
(2) Educar. 2006. Biologia Transcripción del ARN. Fecha de consulta 2 Abril 2011. En línea. Disponible en: http://aportes.educ.ar/biologia/nucleo-teorico/estado-del-arte/como-se-encienden-y-apagan-los-genes-el-dogma-central-de-la-biologia-paso-a-paso/transcripcion.php.
(3) Zamudio Teodora.2005.La transcripción y traducción. Fecha de consulta 2 abril 2011.En línea. Disponible en: http://www.biotech.bioetica.org/clase1-14.htm
Fuentes
1. http://payala.mayo.uson.mx/QOnline/sintesisproteinas.html
2. http://www.porquebiotecnologia.com.ar/educacion/cuaderno/ec_32.asp
3. http://medicpedia.es.tl/Biologia-y-Genetica-Molecular.htm
Investigar las diferentes enfermedades ligadas a la síntesis de proteínas
Algunas enfermedades que se pueden citar son:
· Glucogenosis tipo I :
Se debe a un defecto de la glucosa-6-fosfatasa en hígado, riñón y mucosa intestinal. Se puede clasificar en dos subtipos:
1. Tipo Ia, en el que la enzima glucosa-6-fosfatasa es anómala.
2. tipo Ib, que se debe a un defecto en la translocasa que transporta la glucosa-6-fosfato a través de la membrana microsómica.
Los defectos en los tipos Ia y Ib dan lugar a una conversión hepática inadecuada de la glucosa-6-fosfato en glucosa y, por tanto, hacen que los pacientes afectados sean susceptibles a la hipoglucemia en ayunas.
Figura 1.Signos (fuente 1)
Figura 1.Signos (fuente 1)
Signos:
Estos niños tienen a menudo rostros que parecen de muñeca con carrillos regordetes, extremidades relativamente delgadas, baja estatura y abdomen protuberante a causa de la hepatomegalia masiva; también hay nefromegalia.
Figura 2. Enfermo. (Fuente 2)
Síntomas:
Estos síntomas son especialmente notables en los bebés. Los síntomas de hipoglucemia aparecen a menudo cuando el tiempo entre el aumento de la alimentación y el bebé duerme toda la noche. En los bebés, niños y adultos, los síntomas también pueden Los síntomas estar presentes cuando una enfermedad evita la rutina normal de alimentación y el tiempo. Si el azúcar en la sangre es muy baja, algunos individuos pueden tener convulsiones (ataques hipoglucémicos).(1)
Sus principales síntomas son el agrandamiento del hígado y azúcar en la sangre. Las personas que sufren la enfermedad de tipo I pueden desarrollar hipoglucemia y acidosis láctica durante el período neonatal pero es más frecuente que se manifiesten por hepatomegalia entre los tres y los cuatro meses de edad.
Los bajos niveles de glucosa en la sangre de estas personas a menudo resultan en el hambre crónica, fatiga e irritabilidad. (1)
· Anemia Drepanocítica:
Enfermedad peculiar de la raza negra, conocida en África desde hace centurias. Produce, entre otros síntomas: anemia, dolores reumáticos y de abdomen. En 1919 James Herrick notó la forma anormal de los glóbulos rojos en los individuos afectados ( semilunares, en la hipoxia ). Dado que la enfermedad aparecía en determinadas familias, el estudio del árbol genealógico llevó, en 1941 , a explicarla como el resultado de la homocigotidad a un alelo mutante. En 1951, usando datos familiares complementarios se confirmó la hipótesis de que la enfermedad se heredaba como un factor Mendeliano.(2)
Anemia drepanocítica o de células falciformes es un trastorno hereditario (se transmite de padres a hijos) de la sangre caracterizado por una anomalía de la hemoglobina (proteína presente en los glóbulos rojos cuya función es transportar oxígeno a los tejidos del cuerpo).(3)
 Los glóbulos rojos presentan una forma semilunar anormal (Los glóbulos rojos normales tienen una forma de disco).Dentro de los síntomas y las complicaciones asociadas están la anemia, el secuestro esplénico, el síndrome agudo de tórax, la crisis de dolor o crisis de bloqueo, los accidente cerebrovascular y la ictericia o color amarillento de la piel, los ojos y la mucosa bucal, entre otros muchos.(3)
Los glóbulos rojos presentan una forma semilunar anormal (Los glóbulos rojos normales tienen una forma de disco).Dentro de los síntomas y las complicaciones asociadas están la anemia, el secuestro esplénico, el síndrome agudo de tórax, la crisis de dolor o crisis de bloqueo, los accidente cerebrovascular y la ictericia o color amarillento de la piel, los ojos y la mucosa bucal, entre otros muchos.(3)La anemia drepanocítica se hereda de ambos padres. Este tipo de anemia es mucho más común en personas de ascendencia africana o mediterránea y también se observa en personas de Centro y Suramérica, el Caribe y el Medio Oriente.
· Fibrosis Quística:
 Enfermedad del páncreas, es un trastorno hereditario multisistémico en niños y adultos, caracterizado por la obstrucción e infección en las vías respiratorias y por mal digestión. Enfermedad Genética autonómica recesiva. Se produce como consecuencia de la alteración del brazo largo del cromosoma 7. Su producto la proteínas CFTR al estar alterada determina un transporte anormal de iones en un gran número de células epiteliales en diferentes sistemas y órganos, principalmente el tracto gastrointestinal y respiratorio.(4)
Enfermedad del páncreas, es un trastorno hereditario multisistémico en niños y adultos, caracterizado por la obstrucción e infección en las vías respiratorias y por mal digestión. Enfermedad Genética autonómica recesiva. Se produce como consecuencia de la alteración del brazo largo del cromosoma 7. Su producto la proteínas CFTR al estar alterada determina un transporte anormal de iones en un gran número de células epiteliales en diferentes sistemas y órganos, principalmente el tracto gastrointestinal y respiratorio.(4)• Retinosis pigmentaria
La Retinosis Pigmentaria (RP) es un conjunto de enfermedades oculares de carácter degenerativo, genético y hereditario cuya consecuencia es una gran disminución de la visión debido a la muerte progresiva de las células oculares de la retina denominadas "fotorreceptores", y que, en muchos casos, conduce a la ceguera. El fotorreceptor es la primera neurona de la vía visual y es la célula más abundante de la retina. En la retina humana existen alrededor de 120 millones de bastones encargados de la visión nocturna y en blanco y negro. En la retina periférica, el bastón es el fotorreceptor predominante. Gracias a los bastones, por ejemplo, podemos ver como un objeto se nos acerca cuando se nos ha lanzado desde un lado.Los conos son los encargados de la visión diurna y en color. Los cono son los que determinan la agudeza visual.(5)
Algunos de sus síntomas son:
· Ceguera nocturna.
· Disminución del campo visual.
· Alteración de percepción de colores.
Figura 5. ojo humano.(fuente 5)
Por Kimberly Marín Rodríguez
Universidad internacional de las Américas
Facultad de Farmacia
I cuatrimestre, 2011
Referencias
(1) La Asociación para la enfermedad por almacenamiento de glucógeno.2011. Glucogenosis tipo I. Fecha de consulta 2 de abril 2011.En línea. Disponible en http://www.agsdus.org/html/typeivongierke.htm
(2) Raisman S Jorge, Gonzales Ana María. Síntesis proteica.2000.Fecha de consulta2 de abril de2011. En línea. Disponible en: http://www.efn.uncor.edu/dep/biologia/intrbiol/adntema2.htm
(3) Dr.Kandelah.2010. Anemia drepanocítica o de células falciformes.Fecha de consulta 2 de abril 2011. En línea. Disponible en: http://cr.globedia.com/anemia-drepanocitica-celulas-falciformes
(4) Valverde C, Mariela.2005.Fibrosis Quística. Fecha de consulta 2 abril de 2011. En línea. Disponible en: http://www.binasss.sa.cr/revistas/rmcc/590/art12.pdf
(5) Mayor Andres.Renitosis Pigmentaria. Fecha de consulta abril 2011.en línea.Disponible en: http://www.opticas.info/articulos/retinosis-pigmentaria-1.html
Fuentes
1. http://pi-patologia.blogspot.com/2008/06/patologia-metabolica.html
3. http://cr.globedia.com/anemia-drepanocitica-celulas-falciformes
4. http://sintomas.com.es/fibrosis-quistica
5. http://prevenirlaceguera.blogspot.com/2010/03/retinosis-pigmentaria-una-gran-noticia.html